ANATOMÍA
Riñones:
Los riñones son órganos
retroperitoneales situados entre D-11 y L-3. Su longitud media es de 12 cm
siendo el izquierdo algo mayor que el derecho. El riñón derecho se encuentra
algo más bajo que el izquierdo.
La unidad excretora
renal es la nefrona y consta de:
·
Corpúsculo renal
·
Túbulo contorneado proximal
·
Asa Henle
·
Túbulo contorneado distal
·
Conducto colector
El riñón está formado por un
parénquima rodeado por una cápsula fibrosa.
o
La cápsula fibrosa:
Es una membrana aplicada directamente
sobre el parénquima renal. Se une al riñón por tractos conjuntivos que penetran
al órgano.
o
Parénquima renal
Se compone de dos partes: una central
llamada médula y otra periférica o corteza.
• Médula:
Representada por zonas triangulares de
color rojo oscuro y estriada. Esta zona triangular representa la sección de
masas cónicas llamadas pirámides de Malpighi. Por cada riñón existen
aproximadamente de 8 a 10 pirámides, cuyos vértices hacen prominencia en el
seno y constituyen las papilas renales, las cuales están llenas de
perforaciones por las que se elimina la orina. Las papilas se introducen dentro
de los cálices que reciben la orina.
• Sustancia cortical:
Es de color amarillo rojizo; rodea a
la pirámide de Malpighi, a excepción de las papilas. Forma una parte de una
gruesa capa periférica que separa la base de las pirámides de la superficie del
riñón y, por otra parte, penetra en las pirámides separándolas por medio de las
columnas de Bertín.
La capa periférica de la sustancia
cortical se compone de dos partes: las pirámides de Ferrein y el laberinto.
Ø
Pirámides de Ferrein: son de aspecto estriado
como las pirámides de Malpighi y parecen prolongaciones de éstas hacia la superficie
del riñón.
Ø Laberinto:
es de aspecto granuloso, separa a las pirámides de Ferrein entre sí y de la
superficie del riñón. Además, constituye las columnas de Bertín. El aspecto
granuloso del laberinto se debe a la presencia de innumerables granulaciones
rojizas llamadas corpúsculos de Malpighi. 1
Irrigación:
Ambos riñones reciben una importante
irrigación, la cual representa el 21 a 25% del gasto cardíaco. El 88% del flujo
plasmático renal está destinado a la corteza renal y el 12% restante perfunde
la médula. El flujo sanguíneo en la corteza es rápido y de alta presión.
Contrariamente, en la médula es lento y de baja presión.
Los vasos sanguíneos ingresan y salen
del riñón por el hilio. La arteria renal luego de ingresar al riñón por el
hilio, adosada al uréter y a la vena renal, se ramifica sucesivamente para
formar las arterias interlobares, arcuatas, interlobulares (o radiales) y
arteriolas aferentes que dan lugar a los capilares glomerulares. Los extremos
distales de los capilares de cada glomérulo confluyen y forman la arteriola
eferente que da lugar a una segunda red capilar, los capilares peritubulares
que rodean a los túbulos renales. Los capilares peritubulares terminan en los
vasos del sistema venoso formando sucesivamente la vena interlobular, arcuata,
interlobar y vena renal que sale por el hilio hacia la vena cava caudal.2
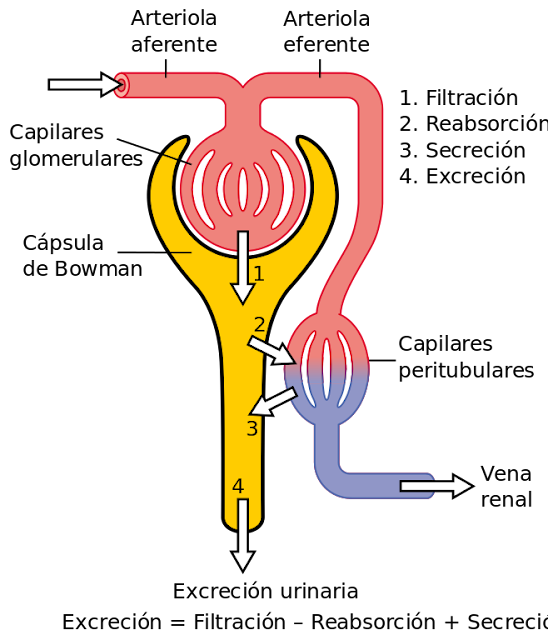
Proceso de formación de orina
1. Filtración:
Las paredes de los capilares y la hoja
interna de la cápsula de Bowman forman una verdadera membrana filtrante. Esta
membrana es totalmente permeable al agua, a las sales inorgánicas y a las
pequeñas moléculas orgánicas. Retiene, en cambio, las células sanguíneas y las
grandes moléculas proteicas (albúmina, fibrinógeno, globulinas). En
consecuencia, se obtiene un primer líquido llamado orina capsular, que tiene
una composición semejante a la del plasma. El mecanismo de la filtración es
pasivo.
2. Reabsorción:
La mayor parte de las sustancias
filtradas son reabsorbidas por las paredes de los túbulos y se incorporan a la
sangre de los capilares peritubulares. De no ser así, muchas de las sustancias
útiles de la sangre se perderían con la orina. El mecanismo de absorción es un
mecanismo activo, es decir, con gasto de energía. La mayor parte del agua
(hasta el 99 %) y una parte importante de sales se reabsorben en los túbulos
por acción de las hormonas.
3. Secreción:
Simultáneamente, algunas sustancias se
eliminan a la orina no por filtración glomerular, sino por secreción tubular.
Ocurre con gasto de energía, pero en sentido contrario a la reabsorción. De
este modo se excretan algunos medicamentos, K+ e hidrogeniones.
4. Excreción:
La orina que sale por los agujeros de
las papilas es recibida por los cálices, que la conducen a la pelvis renal. Por
su especial disposición en relación con el uréter y debido a las contracciones
peristálticas uretrales, que suceden entre una y cinco veces por minuto, la
orina desciende y es llevada a la vejiga, donde llega a razón de 5 a 10 gotas
por minuto.3
RADIOFÁRMACOS
Los radiofármacos renales se
clasifican según sus mecanismos de captación y aclaramiento como sustancias de
filtración glomerular, secreción tubular o unión cortical.
Los radiofármacos renales se dividen
en los que miden la filtración glomerular, la secreción tubular y la fijación
cortical. Las sustancias renales clínicamente más importantes son el Tc -99m
ácido dietileno triamina pentaacetico (Tc – 99m DTPA), el I-131 hippuran (I-131
OIH), el Tc -99m mercaptilacetiltriglicina (Tc-99m MAG3), el Tc – 99m
glucoheptonato (Tc-99m GH), el Tc-99m ácido dimercaptosuccinico (Tc-99m DMSA).4
MECANISMOS DE CAPTACIÓN DE LAS
SUSTANCIAS PARA LA GAMMAGRAFIA RENAL
|
|
Captación
|
Sustancia
|
·
Filtración glomerular (100%)
·
Tubular (100%)
·
Tubular (80 %) y glomerular (20 %)
·
Unión cortical (40%)
·
Filtración glomerular (80%) y unión cortical
(20 %)
|
·
Tc -99m DTPA
·
Tc -99m MAG3
·
I – 131 e I -123 HIPPURAN
·
Tc – 99m DMSA
·
Tc – 99 m glucoheptonato
|
PROTOCOLOS
Gammagrafía
renal dinámica
(Radiorrenograma)
1.-
Indicaciones:
·
Diagnóstico de HTA renovascular.
·
Diagnóstico de uropatía obstructiva.
·
Hidronefrosis.
·
Traumatismo renal.
·
Evaluación de trasplante.
·
Malformación congénita.
·
Litiasis renal.
2.-
Fundamento:
· Los radiofármacos más utilizados son el Tc-99m
DTPA y el Tc-99m MAG3. El DTPA se elimina por filtración glomerular, por lo que
su cinética se altera sensiblemente en caso de insuficiencia renal. La MAG3 se
elimina por secreción tubular y es el radiofármaco de elección en niños y en
caso de insuficiencia.
· El radiotrazador inyectado por vía intravenosa
permite ver el funcionamiento de los riñones (llegada del radiofármaco,
filtrado, tránsito y acumulación en la pelvis renal, eliminación hacia los
uréteres y la vejiga).
3.-
Preparación del paciente:
·
Ayuno de 2 horas (no imprescindible).
·
Explicar el procedimiento detalladamente.
·
Se debe hidratar al paciente
ü
Adultos: beber 300-500 ml de agua
ü
Niños: hidratación intravenosa con 10 – 15
ml/kg durante 30 min
·
Colocación de una vía venosa previa.
·
Orinar antes de empezar el estudio.
·
Si se va a realizar un test de Captopril se
debe suspender 7 días antes los IECA.
4.-
Radiofármaco y dosis:
·
Tc-99m DTPA (ácido dietilen triamino
pentacético).
ü
Adultos :15 mCi
ü
Niños: 200 UCi/kg (2 mCi como mínimo, 10 mCi
como máximo)
·
Tc – 99 m MAG3 (mercapto acetil triglicina).
ü
Adultos: 3-5 mCi
ü
Niños: 100 Uci / kg (1mCi como mínimo a 5 mCi
como máximo)
5.-
Forma de administración y ubicación del paciente:
·
Intravenosa, en forma de bolo con el paciente
colocado bajo cámara.
· Se coloca al paciente en decúbito supino sobre
la camilla, con el colimador en la parte posterior incluyendo la región
abdominal (desde el apéndice xifoides del esternón hasta la sínfisis del
pubis).
· En el caso de evaluación postransplante el
colimador se coloca en la región anterior del paciente incluyendo fosa pélvica
(sitio de transplante).
6.-
Protocolo de adquisición:
· PRE-JERINGA: Antes de administrar la dosis al
paciente; se cuenta la dosis completa del radiofármaco colocando la jeringa a
30 cm del colimador en una imagen estática de 1 minuto, usando una matriz de 64
x 64.
·
RRG: El estudio consta de dos fases y tiene
una duración total de 30 min.
a.
Fase 1 o Fase vascular: donde se adquiere 1
imagen por segundo durante 60 segundos.
b.
Fase 2 o Fase parenquimatosa: se adquiere 1
imagen cada 20 segundos durante 1800 segundos.
ü
Modalidad de adquisición: imágenes
dinámicas.
ü
Colimador de LEHR.
ü
Fotopeak centrado en 140 Kev con ventana de un
20%.
ü
Matriz: 64x64.
ü
Zoom: opcional, si es un paciente pediátrico
sí.
Se
administra la dosis en forma de bolo e inmediatamente se comienza la
adquisición de las imágenes. Comenzar en el momento que se ve bajar el
radiotrazador por la aorta.
· POST-JERINGA: Cuando el paciente ya se retiró
de la camilla, se cuenta la dosis residual de la jeringa colocándola a 30 cm
del colimador en una imagen estática de 1 minuto, usando una matriz de 64 x 64.
· POST MICCIÓN: Se puede adquirir una imagen
estática post miccional o tardía de 90 minutos usando matrices de 64x64 o 128x128.
7.-
Procesamiento:
· Se debe registrar la talla y el peso del
paciente, así como si la evaluación es de un riñón, de ambos o de un
transplante.
· Finalizada la adquisición se dibujan ROI sobre
la imagen del riñón derecho, riñón izquierdo, aorta y fondo. El sistema
informativo acumula la actividad (número de cuentas) procedente de estas áreas
y su variación a lo largo de la exploración, a medida que el trazador va siendo
eliminado. Esta representación gráfica en forma de curva se denomina curva
actividad-tiempo. Para evitar valorar como actividad renal la actividad
procedente de los tejidos circundantes, se marcan regiones en zonas
perirrenales que representan la radiación de fondo (debe evitarse los grandes
vasos y los uréteres). De las curvas obtenidas de la actividad contenida en las
ROI renales se sustrae la curva de actividad de fondo.
· El software permite obtener de las curvas los
datos de tiempo en el pico máximo de concentración, tiempo medio de eliminación
y relación máxima de captación entre ambos riñones. Así como el flujo plasmático
efectivo renal o el porcentaje de filtración glomerular global y por cada
riñón.4,6,7,8,9,10
Renograma normal:
·
Fase de
flujo:
Es la primera fase llamada también fase
vascular. Normalmente, el flujo sanguíneo de los riñones se observa a los 2-5 segundos
de visualizar la aorta y muestra un ascenso rápido de la actividad renal que se
extiende hasta los 30 – 40 s.
Es un reflejo de la llegada por via
sanguínea del trazador y, por tanto, valora el aporte sanguíneo al riñón
(perfusión renal).
Es importante evaluar la calidad del
bolo de la inyección, ya que el retraso de la visualización renal puede ser un
artefacto debido una técnica de inyección inadecuada. Si la pendiente de la
curva tiempo actividad arterial no es pronunciada o si persiste la actividad
visible en corazón y los pulmones, es posible que la inyección haya sido
demasiada prolongada. Las asimetrías en la actividad del trazador indican
perfusión anormal en el lado en que la actividad esta disminuida o retrasada.
Si un riñón es más pequeño o tiene cicatrices, tendrá menos flujo debido a una
disminución del volumen del tejido del parénquima.
·
Fase de la
función cortical.
La segunda fase o fase de captación corresponde
a un ascenso más lento de la actividad renal que refleja la incorporación y
transito intrarrenal del trazador. En esta fase también comienza la eliminación
urinaria, pero como sigue llegando radiofármaco a través de la sangre, el
balance entre lo que llega y lo que se elimina es positivo y justifica que la
actividad renal siga aumentando, hasta alcanzar un pico máximo alrededor de los
3 – 5 min.
Similar a un pielograma intravenoso,
el radiofármaco se acumula en los riñones normales en el tejido del parénquima
en los primeros minutos. La corteza debe aparecer homogénea. Los cálices y la
pelvis renal no se observan en esta fase inicial o aparecen relativamente
fotopenicos. Si la función esta disminuida en un lado, la tasa de captación y
la función suelen retrasarse con respecto al lado relativo al riñón que
funciona mejor. Esto produce un patrón en “flip, flop”; el lado que funciona
peor tiene menos captación al principio, pero la actividad cortical en las
últimas imágenes es más alta que en el lado que funciona mejor, que ya ha
excretado el radio trazador.
·
Fase de
aclaramiento:
La tercera fase o fase de eliminación
comienza cuando predomina la eliminación sobre la captación renal.
Generalmente, los cálices y la pelvis
empiezan a llenarse a los 3 minutos. En los siguientes 10-15 minutos, la
actividad en el riñón y el sistema colector disminuye. Si la función es buena,
la mayoría del radiotrazador se aclara hacia la vejiga al final del estudio. En
algunos sujetos sanos, la reserva de actividad en los cálices dependientes
puede producir manchas calientes focales. La falta de aclaramiento o
solapamiento de las estructuras pelvicaliciales sobre la corteza indica
hidronefrosis. Puesto que las áreas donde aumenta la actividad parecen más
grandes, hay que tener cuidado cuando se diagnostica hidronefrosis en los
estudios de gammagrafía.
Es posible que los uréteres normales
no se visualicen. Si la actividad se prolonga, no cambia o aumenta, indica
dilatación. Puesto que la peristalsis y las tasas de flujo de la orina producen
esta visualización variable, hay que tener cuidado cuando se diagnostica
reflujo hacia los uréteres cuando la actividad permanece en el riñón. En estos
estudios, puede determinarse el reflujo de forma indirecta cuando la actividad
ureteral persiste después de que los riñones se han aclarado. Sin embargo, el
reflujo se detecta mejor con un vesicoureterograma (VCUG) directo cuando la
actividad se introduce directamente en la vejiga con un catéter.
Normalmente, la vejiga se ve bien. Con
las imágenes de la vejiga antes y después de la micción se evalúa el vaciado y
el residuo después del vaciado. Una vejiga distendida puede producir un patrón
de obstrucción. En un paciente con la vejiga neurogena u obstrucción de salida,
la gammagrafía renal se realiza mejor colocando un catéter urinario. En los
lactantes y los niños pequeños, la vejiga puede parecer demasiado grande y en
una posición más alta de lo que podría esperarse cuando se observa el perfil
del cuerpo del niño.
Curvas del radiorrenograma
La CTA de la perfusión de primer paso
muestra el flujo sanguíneo de cada riñón comparado con el flujo arterial. Se
traza una región de interés alrededor de cada riñón y la arteria principal más
cercana (la aorta para los riñones nativos, la arteria iliaca para los riñones
trasplantados) en los primeros 60 segundos del estudio.
Aunque el flujo absoluto no puede
calcularse con el radio marcador, puede visualizarse el flujo relativo o puede
calcularse utilizando la parte ascendente de la curva de perfusión. Una tasa de
la actividad comparada con la aorta puede ayudar a seguir los cambios de
perfusión.
Curva
tiempo - actividad de la función renal dinámica.
La función cortical dinámica se evalúa
con una región de interés renal (ROI) corregida para la actividad de fondo. La
selección del ROI depende de la información necesaria. Puede utilizarse una ROI
de todo el riñón para la función cortical si el sistema colector aclara
enseguida. Cuando se usa una ROI de todo el riñón en un paciente en el que la
actividad queda retenida en el sistema colector, el aclaramiento aparecerá
retrasado en la curva tiempo -actividad(CTA). En los casos de hidronefrosis y
obstrucción es mejor una ROI cortical periférica de 2 pixeles de ancho que
excluya el sistema colector, aunque es inevitable que haya algo de solapamiento
con los cálices.
Se han utilizado varios métodos para corregir
el fondo. Se traza una región de interés de 2 pixeles de ancho. Puede colocarse
debajo de los riñones, alrededor de los riñones o en una configuración de
medialuna.
Puesto que los riñones se superponen
con el hígado y el bazo en la ROI del fondo. Corregir el fondo es menos critico
en las imágenes retardadas, como las que se obtienes con Tc -99m DMSA, debido a
la proporción objetivo a fondo alta en estas imágenes retardados.
Función
diferencial:
La función diferencial o de división
es un cálculo que se realiza de forma universal. Es necesaria una ROI de todo
el riñón para que no se excluya la corteza. La ROI se relaciona para generar
una CTA que represente la cantidad de actividad en cada riñón durante la fase
máxima del nefrograma.
Los valores se seleccionan en el rango
de 1 – 3 minutos después de la inyección (después de la fase del flujo
sanguíneo y antes de la fase excretora). El recuento real en cada riñón se
expresa como una función de la función total del 100 %. Normalmente, la
contribución relativa de cada riñón esta entre el 45 y el 55%. Este valor no
indica si la función renal total o global es normal o anormal. Puede hacerse un
cálculo de la TFG como estudio separado para cuantificar la función renal.
Parámetros
de normalidad
Función renal diferencial
50% ± 5%, eficiencia de salida: 78 % a los 30 minutos
Curvas renográficas simétricas con pendiente funcional ascendente, tiempo de captación máxima (Tmax) de 3-5 minutos y pendiente de excreción descendente.
Curvas renográficas simétricas con pendiente funcional ascendente, tiempo de captación máxima (Tmax) de 3-5 minutos y pendiente de excreción descendente.
Parámetros de anormalidad
·
Función renal relativa < 45%, eficiencia de
salida < 78 % a los 30 minutos.
·
Diferencia de 60 seg o más en el Tmax.
·
Alteraciones de captación parenquimatosa.
·
Retención pielocalicial.
·
Alteración de la morfología de la curva renal.
·
Alteraciones de la posición, forma y/o tamaño
renal.10
Medida de la TFG
En el laboratorio, es posible
cuantificar con exactitud la TFG y el FPRE (Flujo Plasmático Renal Eficaz) con
sustancias que no son radiactivas. La molécula de inulina es el modelo para
medir la TFG, ya que se filtra libremente en el glomérulo, pero no se secreta
en los túbulos si se reabsorbe. Si una sustancia tiene una extracción de primer
paso completa a través del riñón puede medir el FPR. Aproximadamente el 90 %
del PAH se extrae y se ha usado para estimar el FPR; sin embargo, como se aclara
de forma incompleta, se usa el termino FPRE. La inulina y el PAH son muy
exigentes técnicamente, y se necesita una infusión continua para conseguir un
estado estable; entonces se mide el aclaramiento en varias muestras de orina y
de sangre.
Se han utilizado muchos radiofármacos
análogos de la inulina para evaluar la filtración glomerular.
Los valores normales de la TFG son de
aproximadamente 100 ml /min para los adultos. Los resultados son exactos a
menos que la función este muy disminuida (TFG <30ml/min). En los niños, la
función renal alcanza los niveles de los adultos a los 2 años. Los valores
pediátricos de la TFG deben corregirse según la superficie corporal.
Con el fin de calcular la TFG
basándose en la cámara, se cuenta una dosis pequeña conocida de Tc-99m DTPA a
una distancia fija desde la cara de la cámara para determinar la tasa de
recuento antes de inyectarla al paciente. Entonces se corrige la dosis real
administrada por la pos inyección residual de la jeringa y sirve como un estándar.
Si la dosis es demasiado grande, puede sobrepasar la capacidad de recuento del
sistema y los recuentos perdidos afectan a la exactitud produciendo
sobreestimación de la TFG.
Después de la inyección, se adquieren
las imágenes durante 6 minutos. Se trazan las ROI alrededor de los riñones y
los recuentos se sustraen del fondo. La atenuación de los fotones causada por
la profundidad renal variable se corrige utilizando fórmulas que se basan en el
peso y altura del paciente. La fracción estándar que se acepta para los riñones
en los fotogramas de 1-2,5 minutos o 2-3 minutos se relaciona con la medida de
la TFG por uno de los métodos estándar aceptados. 4
Estudios
adicionales:
Renograma
diurético:
La obstrucción de la via urinaria
puede ser debida a varias causas, entre las que destacan: cálculos, tumores y estenosis
(secundarias a infecciones o a traumatismos) de la via urinaria, hipertrofia y
cáncer de próstata. Aunque la obstrucción aguda presenta una clínica expresiva
la obstrucción crónica puede evolucionar de modo silente, dañando al riñón de
modo irreversible.
Cuando existe sospecha de uropatía
obstructiva y la ecografía sea negativa o dudosa, sobre todo si se acompaña de
valores altos de creatinina plasmática que contraindican el uso de contraste yodado,
los estudios isotópicos son una buena opción.
En fases iniciales de la uropatía
obstructiva la curva renográfica se caracteriza por la ausencia de la fase de
eliminación, de actividad descendente. Al contrario, la actividad asciende o
continua en un trazado casi plano, en meseta. A medida que la función renal se
deteriora la pendiente de la fase de captación desciende, para terminar, en la
anulación funcional del riñón, con un trazado plano.
La dificultad en la excreción no
siempre se debe a una obstrucción, podría ser también por una ectasia urinaria,
es decir, una dilatación de la via urinaria con remanso de orina, por ejemplo,
por un reflujo vesicoureteral, sin obstrucción real.
Esta modalidad de Radiorrenograma
permite diferenciar la obstrucción real de la ectasia.
La técnica de adquisición es idéntica a la del renograma basal, con la modificación de administrar un diurético, la furosemida, por via intravenosa ,15-20 min después de administrar el radiofármaco.
La técnica de adquisición es idéntica a la del renograma basal, con la modificación de administrar un diurético, la furosemida, por via intravenosa ,15-20 min después de administrar el radiofármaco.
Dosis de furosemida: 1mg/kg de peso
- Adultos: 40 mg como máximo
- Niños: 20 mg como máximo
El diurético, al aumentar la producción
de orina, <fuerza> la eliminación en caso de ectasia y en el renograma se
aprecia un brusco descenso de la curva, mientras que en caso de auténtica
obstrucción la respuesta es nula.
Renograma
posterior a la administración de inhibidores de la enzima convertidora de
angiotensina:
En más del 90 % de los pacientes con
hipertensión arterial no puede identificarse una causa. En una proporción
significativa de estos pacientes, la hipertensión renovascular (HRV) es la
responsable del aumento de su presión arterial. Las dos causas principales de
HRV son la aterosclerosis y la displasia fibromuscular.
Cuando una lesión arterial produce
estenosis vascular significativa en la arteria renal o una de sus ramas
principales, la presión de perfusión glomerular cae, haciendo que la filtración
glomerular disminuya. El riñón responde liberando la hormona renina desde el
aparato yuxtamedular. La renina convierte el angiotensinógeno formado en el
hígado en angiotensina I. En los pulmones, la enzima convertidora de
angiotensina (ECA) convierte la angiotensina I en angiotensina II vasoactiva,
que actúa como un vasoconstrictor potente. Esta constricción actúa
periféricamente para aumentar la presión sanguínea y actúa sobre las arterias
eferentes del glomérulo para aumentar la presión de filtración, manteniendo así
la TFG.
Si el flujo sanguíneo renal sigue
siendo bajo, el riñón cicatriza y se contrae con el tiempo. Si hay HRV, la
intervención temprana disminuye la lesión arteriolar y la glomeruloesclerosis.
Esto aumenta la posibilidad de curación.
El efecto compensador desencadenado
por la renina justifica que el renograma basal en pacientes con sospecha de
hipertensión vasculorrenal pueda ser normal. Para elevar la especificidad de la
prueba se debe realizar un renograma posterior a la administración de
inhibidores de la enzima convertidora de angiotensina(IECA). Los que se pueden
utilizar son el captopril y la enalapril. Ambos inhiben la enzima convertidora
de angiotensina por lo que impiden la producción de angiotensina II y, por
tanto, anulan la reacción compensadora del organismo ante la estenosis renal y
ponen de manifiesto la lesión.
El protocolo de adquisición es similar
al renograma basal, con la modificación de administrar el IECA.
Protocolo
de 2 días: Lo habitual es proceder a la realización de un renograma post
IECA y si es patológico realizar un renograma basal. Se usan dosis de 3-6 mCi.
Protocolo
de 1 día: Se realizar dos renogramas el mismo día uno inicial o basal y
otro, horas más tarde tras la administración del IECA. Utilizar 1-2 mCi para el estudio basal y
después 5-10 mCi para el estudio con inhibición de la ECA.
·
Preparación
del paciente:
ü
Liquido solo 4 horas antes del estudio.
ü
Hidratación: 7 ml/kg agua 30 – 60 minutos
antes del estudio o hidratación intravenosa con 10 ml/kg (máximo 500ml) de
suero salino semi normal en 1 hora.
ü
Mantener una vena abierta durante el estudio
por si se produce hipotensión.
ü
Interrumpir ciertos fármacos: inhibidores de
la ECA (3 días para las sustancias de acción corta,5-7 días para las sustancias
de acción larga), bloqueantes del receptor de angiotensina; considerar
interrumpir los antagonistas del calcio y los diuréticos.
·
Procedimiento
de la prueba de imagen
1. Comprobar la presión arterial
basal.
2. Administrar el inhibidor de la ECA.
Captopril: por via oral una hora antes
del estudio
- Adultos:
25 -50 mg (disuelto en agua)
- Niños:
0,5 mg/kg (hasta un máximo de 25 mg)
Enalapril: por via intravenosa
infundidos durante 3-5 minutos; 15 min antes de administrar el radiofármaco.
- 40ug/kg
(hasta un máximo de 2,5mg)
3.Comprobar y registrar la presión
arterial cada 15 minutos con los fármacos orales y cada 5 minutos con enalapril
i.v.
Si la presión disminuye mucho puede
ser necesario administrar líquidos i.v.
4.Inyectar el radiofármaco 60 minutos
después del captopril oral o 15 minutos después de la enalapril.
5.El protocolo para tomar las imágenes
es parecido al de la renografia dinámica.
Los cambios provocados por el IECA en
el renograma pueden ser:
a.
En las imágenes gamma graficas secuenciales,
tras la administración del IECA la captación del riñón sano no cambia o se
incrementa levemente. En cambio, el riñón enfermo muestra un importante
descenso de actividad, también una asimetría en tamaño y captación.
b.
En la curva actividad/tiempo se observa, en el
riñón enfermo, un retraso del pico máximo y un alargamiento en la fase de
eliminación.
Gammagrafía
Renal
(Técnica de
imagen cortical)
1.- Indicaciones:
·
Detección de cicatrices corticales renales en
la pielonefritis.
·
Malformaciones o mal posiciones renales (riñón
en herradura).
·
Infecciones urinarias altas (pielonefritis
aguda).
·
Valoración pre-nefrectomía.
2.- Fundamento:
·
Es un estudio estático. La adquisición de
imágenes estáticas requiere un trazador que sea captado y retenido por las
células de los túbulos renales el tiempo suficiente para adquirir la imagen
antes de ser secretado a orina y eliminado.
·
El Tc-99m DMSA tiene una eliminación por
filtración glomerular muy baja, debido a su unión casi total a proteínas plasmáticas.
A los 60 – 90 min de su administración el 50% de la dosis ha sido captada por
células de los túbulos renales, pero su secreción a orina es lenta lo que
permite adquirir imágenes sobre todo de la corteza renal, donde se concentra,
fundamentalmente en los túbulos proximales.
3.- Preparación del paciente:
·
2 hs. de ayuno (no imprescindible).
·
Correcta hidratación
·
Explicar el procedimiento detalladamente.
4.- Radiofármaco y dosis:
·
Tc-99m DMSA (ácido dimercapto succínico).
- Adultos: 5 mCi
- Niños: 50 mg/kg (dosis mínima de 600 uCi)
5.- Protocolo de adquisición:
·
Se inyecta el radiofármaco por via
intravenosa.
·
Comenzar: 2 hs post-inyección.
·
El paciente debe orinar antes de empezar.
·
Modalidad de adquisición: imágenes
estáticas.
·
Colimador de LEHR.
·
Fotopeak centrado en 140 Kev con ventana de un
20%.
·
Paciente en decúbito supino.
·
Se adquieren imágenes de 300 seg. en adultos y
600 seg. en niños.
·
Matriz: 128x128.
·
Zoom: x2 en adultos y x3 en niños.
·
Se adquieren imágenes con el colimador
paralelo para 500kc en las vistas anterior y posterior para diferentes
cálculos.
·
Las imágenes estenopeicas(pinhole) se
adquieren para recuentos de 100 k por vista.
·
Se coloca al paciente para que puedan
obtenerse imágenes de cada riñón por separado, pero la cámara está a la misma
distancia del paciente.
·
Se obtienen al final imágenes en proyección PA,
OPD y OPI.
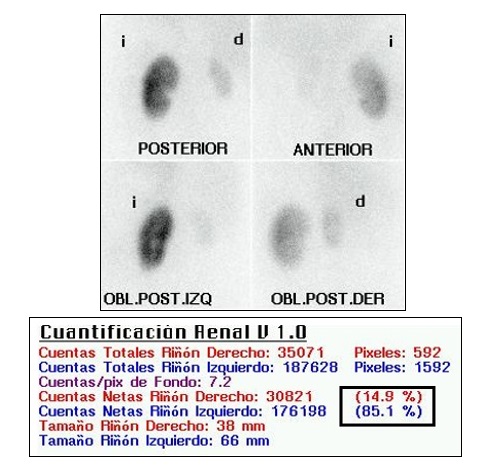
6.- Observaciones:
·
Para evaluar cicatrices renales se puede hacer
adicionalmente imágenes oblicuas posteriores derecha e izquierda, con las
mismas condiciones de adquisición que la imagen posterior.
·
En los casos de riñón en herradura se debe
hacer además una imagen anterior con las mismas condiciones.
7.- Interpretación:
·
La gammagrafía normal debe mostrar una
distribución homogénea a través de la corteza renal. La formal del riñón es
variable, así como el groso de la corteza. Los polos superiores suelen aparecer
con menos intensidad debido a la impresión esplénica en la corteza, la
lobulación fetal y la atenuación por el hígado y el bazo.
·
El sistema colector central y las regiones
medulares son foto deficientes, ya que se produce unión tubular del Tc -99m
DMSA en la corteza.
·
Las columnas de Bertín mostraran captación del
radiofármaco y pueden aparecer bastante prominentes.
·
Las áreas de disfunción tubular cortical
debido a infección o cicatrices se presentan como defectos corticales. Esto
puede estar causado por el efecto de masa localizado (quistes, tumores renales)
y el edema debido al proceso inflamatorio, así como por la disfunción tubular
renal y la isquemia.
·
El diagnóstico de la propagación de una
infección urinaria desde el tracto urinario inferior al riñón no es fácil, especialmente
en niños pequeños y lactantes. La detección de la lesión cortical derivada de
la pielonefritis aguda permite un tratamiento precoz y la curación total. En
caso contrario, puede evolucionar hacia una fibrosis con atrofia y retracción
de la corteza, formando la cicatriz cortical.
·
El estudio isotópico permite, además
cuantificar el daño que la patología ha provocado en la función renal. Para
ello se marcan ROI renales y áreas de fondo perirrenales y se cuantifica el
número de cuentas netas procedentes de cada riñón. Se puede así conocer el
porcentaje de la dosis administrada captada por cada riñón (función renal
relativa) y, al confrontarla con los valores normales, determinar el tejido
renal funcionante, dato que en ocasiones puede modificar la opción terapéutica.
·
Los valores normales de función renal relativa
se sitúan entre el 45 y el 55%.4,6,7,8,9,10
BIBLIOGRAFIA
1. Gartner L. Texto Atlas de Histología, 2da
Edición [7 Cartílago y hueso]. Disponible en: https://librosdmedicina.blogspot.pe/2016/05/texto-atlas-de-histologia-2da-edicion.html
2. Arévalo M. El riñón normal. Desarrollo,
estructura y funciones. Disponible en: http://media.axon.es/pdf/70992.pdf
3. Barone R.
Anatomía y fisiología del cuerpo humano. Buenos Aires-Argentina.
Disponible en: http://www.colimdo.org/media/4277966/anatomofisiologia.pdf
4. O'Malley J., Ziessman H., Thrall J.Medicina
nuclear: los requisitos en radiología. Elsevier - España. 2007.
5. Chain Y., Illanes L. Radiofármacos en medicina
nuclear. Fundamentos y aplicación clínica. Editorial de la Universidad de la
Plata.2015. Disponible en: http://sedici.unlp.edu.ar/handle/10915/46740
7.
Manual de
operaciones de medicina nuclear. Estudios gammagráficos y SPECT-CT. Jun 15.Rev.3.
Disponible en: http://iso9001.inr.gob.mx/Descargas/iso/doc/MOP-SDP-01.pdf
8.
Opazo C.
Manual de procedimientos - Medicina
Nuclear 2011 – 2014. Hospital Clínico Viña del Mar. Disponible
en: http://www.nuclearvina.com/ManualesTecnicos.php
9.
Rivera
B. Manual de procedimientos técnicos del
servicio de medicina nuclear. Instituto nacional de enfermedades
respiratorias “ISMAEL COSÍO VILLEGAS” .
2010. Disponible en: http://www.iner.salud.gob.mx/media/409389/MP_SERVMEDICINANUCLEAR_15102010.pdf
10. Soroa, Victoria. et al. Centellografía Renal
Dinámica Basal. Alasbimn Journal 6(22): October 2003. Article N°
AJ22-12. Disponible
en: http://web.uchile.cl/vignette/borrar3/alasbimn/CDA/imprime/0,1208,PRT%253D6117,00.html
1. Tecedu
UVM.Riñon. [Video File].2015 junio 10. [4:23 min.].
Disponible en: https://www.youtube.com/watch?v=x6sBg-ztexk
2. Palacios R. Video 3D: filtrado glomerular y formacion de la orina. [Video File].2012 marzo 14 . [2:01 min.]. Disponible en: https://www.youtube.com/watch?v=dfKQ7A-9yZ0
VIDEOS:
2. Palacios R. Video 3D: filtrado glomerular y formacion de la orina. [Video File].2012 marzo 14 . [2:01 min.]. Disponible en: https://www.youtube.com/watch?v=dfKQ7A-9yZ0

















Comentarios
Publicar un comentario